I farmaci per l’obesità basati su incretine – come semaglutide (Wegovy; Ozempic a dosaggi per il diabete) e tirzepatide (Mounjaro/Zepbound) – hanno cambiato in modo sostanziale il trattamento dell’obesità.
I cali di peso osservati nei trial possono essere importanti e clinicamente rilevanti. Ma l’obesità resta una condizione cronica e recidivante.
Per questo la domanda “cosa succede se li interrompo?” non è da sottovalutare: la risposta riguarda non solo il mantenimento del peso nel tempo ma anche il consolidamento dei benefici su pressione, glicemia e massa grassa.
Le raccomandazioni più aggiornate trattano la farmacoterapia dell’obesità come una strategia di lungo termine. Il Canadian Adult Obesity Clinical Practice Guideline – aggiornamento 2025 sulla farmacoterapia – esplicita che questi farmaci mostrano una maggiore efficacia e sono ben tollerati soprattutto quando vengono contestualizzati in un percorso continuativo e di lungo periodo.
Questo perché gli studi mostrano una ripresa del peso e una regressione dei benefici ottenuti al momento della sospensione.
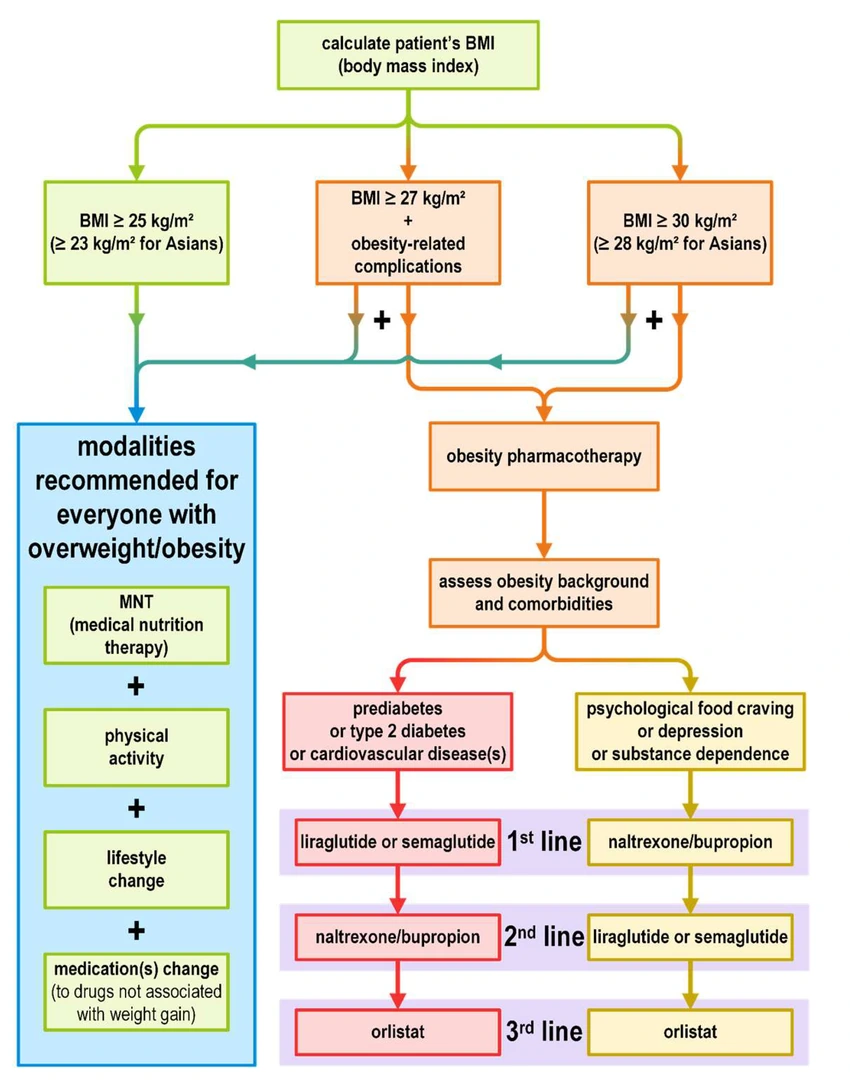
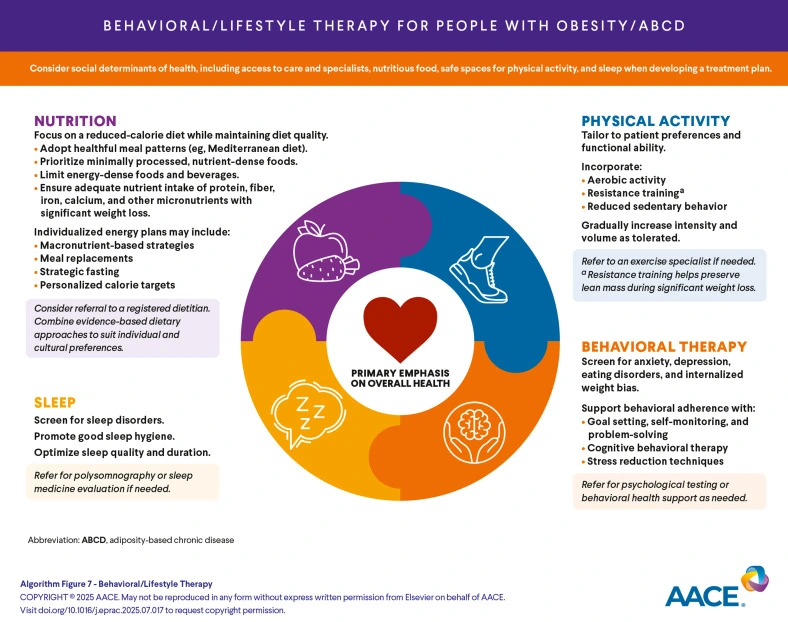
Lo stesso pensiero è condiviso dall’algoritmo diagnostico AACE 2025, che inquadra l’obesità come malattia cronica e sottolinea la necessità di ragionare in termini di mantenimento. Anche il framework EASO 2025 insiste su personalizzazione, gestione delle complicanze e visione a lungo termine.
Il messaggio da portarsi a casa è chiaro: non si tratta di una terapia acuta da concludere nel breve termine, ma di integrare il farmaco in un piano terapeutico strutturato, con obiettivi realistici di mantenimento e assieme ad un professionista preparato.
Le revisioni sistematiche più recenti sono piuttosto chiare: dopo l’interruzione dei farmaci per la gestione del peso, in media si osserva recupero ponderale e una parziale regressione dei miglioramenti cardiometabolici.
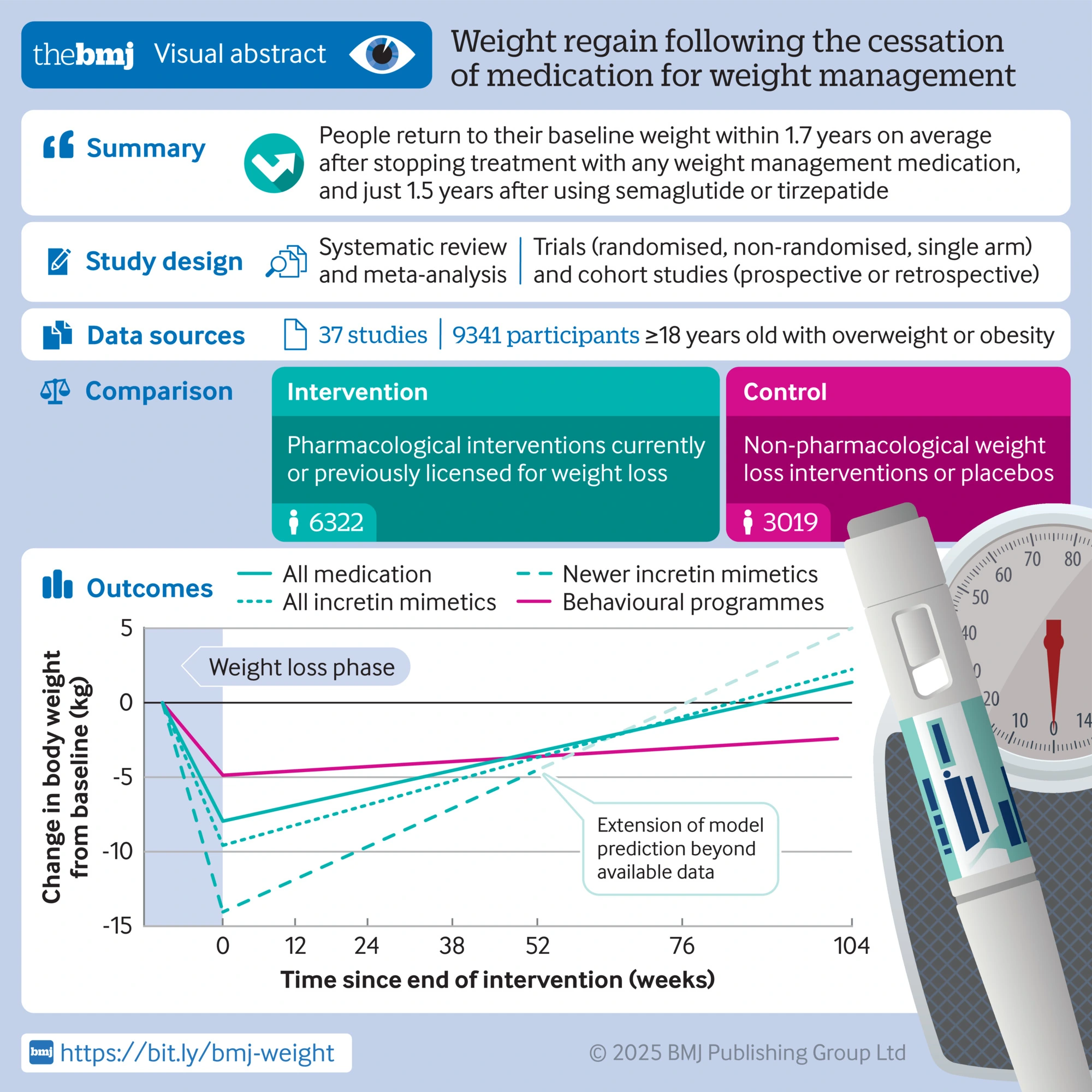
Una revisione sistematica e meta-analisi pubblicata su BMJ nel 2026 ha analizzato la ripresa del peso dopo la cessazione di diversi farmaci anti-obesità. Il dato medio mostra una rapida ripresa ponderale e un ritorno verso i valori basali di pressione, glicemia e un peggioramento del metabolismo lipidico.
Il lavoro evidenzia anche che il recupero di peso dopo l’uso di questi farmaci può essere più rapido rispetto a quello osservato dopo interventi comportamentali isolati.
È importante sottolineare un limite: le meta-analisi aggregano classi di farmaci e popolazioni diverse, quindi non permettono di prevedere con precisione cosa accadrà al singolo individuo. Esiste una variabilità individuale significativa di cui tener conto.
Alcuni studi sono stati progettati proprio per rispondere alla domanda sulla sospensione del farmaco, confrontando appunto la continuazione del farmaco con un passaggio a placebo dopo una fase iniziale di calo ponderale.
Nel trial STEP 1 extension su semaglutide 2,4 mg, dopo 68 settimane di trattamento, la sospensione è stata seguita, nell’arco di un anno, dal recupero di una quota rilevante del peso perso, insieme a un peggioramento parallelo di diversi parametri cardiometabolici verso il basale.
Nel trial STEP 4, chi è passato a placebo dopo una fase iniziale con semaglutide ha ripreso peso, mentre chi ha continuato il trattamento ha mantenuto o ulteriormente migliorato il risultato.
Un disegno di studio simile è stato utilizzato nel SURMOUNT-4 con tirzepatide. Dopo una fase iniziale open-label (scienziati "consapevoli") con calo ponderale significativo, i partecipanti randomizzati a placebo hanno mostrato recupero un del peso, mentre la continuazione del farmaco ha consentito di mantenere una parte sostanziale del calo ottenuto. Analisi successive hanno collegato l’entità del recupero anche al peggioramento di alcuni marker cardiometabolici.
Il quadro complessivo è chiaro: in media, continuare il trattamento con il farmaco aiuta a mantenere il peso e i risultati ottenuti. Sospenderlo porta al recupero del peso, con ampia variabilità individuale.
Nel caso di Ozempic utilizzato in persone con diabete tipo 2, la sospensione non riguarda solo il peso ma anche il controllo glicemico. Interrompere il trattamento senza un’alternativa può peggiorare la gestione del diabete, motivo per cui la decisione va sempre inquadrata nel percorso diabetologico complessivo assieme ad un endocrinologo specializzato.
Le linee guida ricordano inoltre che questi farmaci non sono indicati in gravidanza e allattamento, e che in caso di ricerca di gravidanza la sospensione va pianificata con anticipo.
La prima aspettativa realistica è che la probabilità di riprendere peso dopo lo stop sia alta.
Questo non rappresenta un fallimento personale da attribuire al paziente, ma è coerente con la fisiopatologia dell’obesità, che comporta adattamenti biologici in termini di fame, sazietà e dispendio energetico quando viene meno l’effetto farmacologico.
Se si decide di interrompere, è utile considerarlo come un passaggio terapeutico da pianificare: rafforzare le strategie comportamentali, monitorare peso e parametri metabolici e discutere eventuali alternative con il medico, sono tutti fattori da considerare prima della sospensione del farmaco.
Le evidenze più solide oggi derivano dagli studi di continuazione vs placebo; le strategie ottimali di “tapering” o dosi di mantenimento hanno ancora dati limitati.
In media si osserva un recupero significativo, ma con ampia variabilità individuale. Non tutti riprendono tutto il peso perso, ma la probabilità in genere è alta.
Le strategie di tapering (riduzione graduale) hanno ancora dati limitati. Le evidenze più solide riguardano continuazione vs sospensione netta. La decisione va personalizzata con il medico endocrinologo.
Oltre al peso, può peggiorare anche il controllo glicemico. La sospensione deve essere inserita in un piano diabetologico individualizzato e specifico per il paziente.